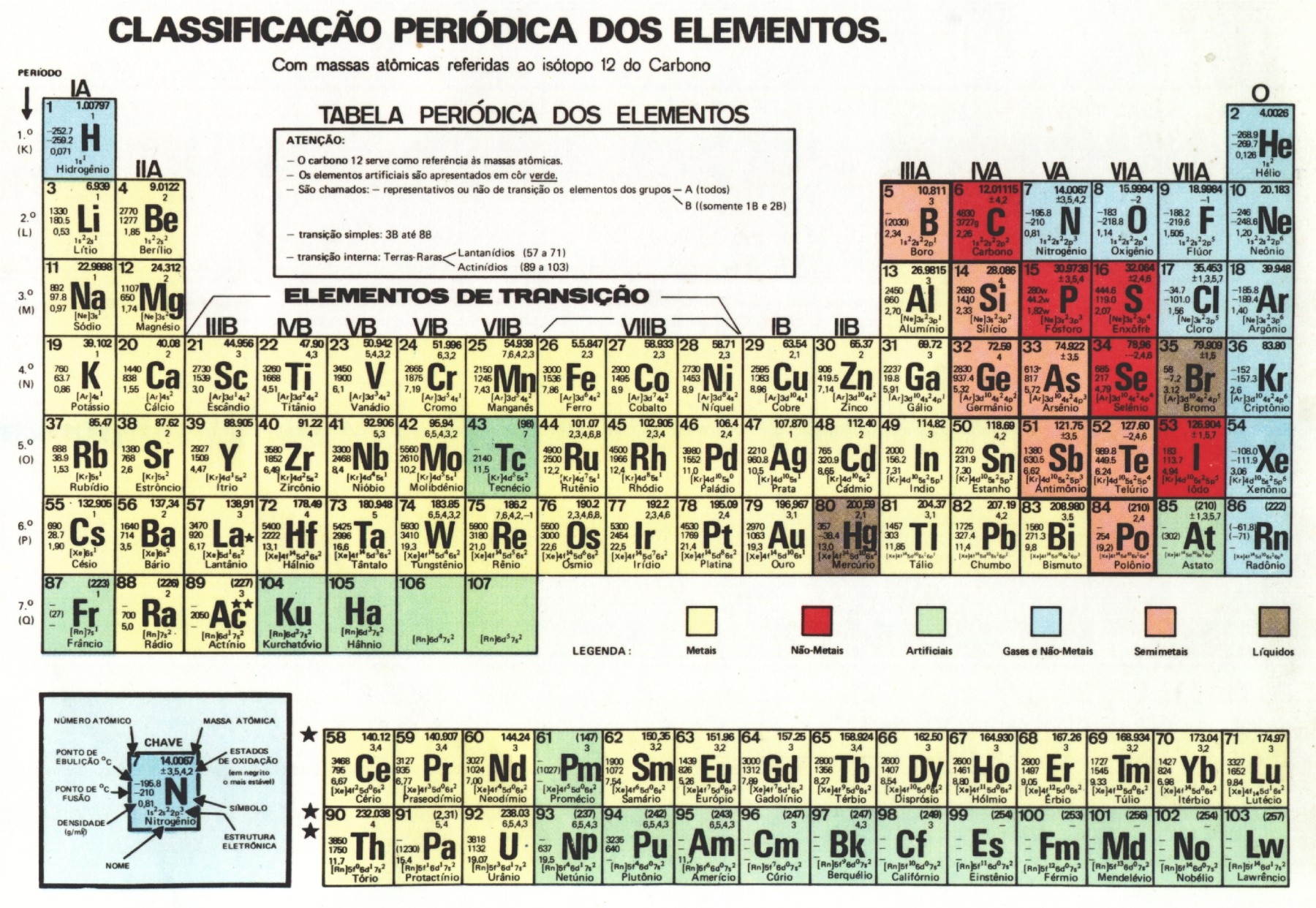
Tabela Periódica (9º ano)
Em Química, os critérios utilizados para a organização dos elementos químicos foram estabelecidos ao longo do tempo. No ano de 1869, Dimitri Mendeleev iniciou os estudos a respeito da organização da tabela periódica através de um livro sobre os cerca de 60 elementos conhecidos na época, cujas propriedades ele havia anotado em fichas separadas. Ao trabalhar com esses dados ele percebeu que organizando os elementos em função da massa de seus átomos, determinadas propriedades se repetiam diversas vezes, e com uma mesma proporção, portanto era uma variável periódica. Lembrando que periódico é tudo o que se repete em intervalos de tempo bem definidos, como é o caso das estações do ano e das fases da lua, por exemplo.
Ela foi criada com o intuito de organizar as informações já constatadas a fim de facilitar o acesso aos dados. Quando foi proposta muitos elementos ainda não haviam sido descobertos, muito embora seu princípio seja seguido até hoje com 118 elementos. Alguns outros modelos de tabela vêm sendo propostos, como por exemplo a que apresenta forma de espiral proposta por Philip Stewart com base na natureza cíclica dos elementos químicos, porém a mais utilizada ainda é a de Mendeleev.
Dimitri Ivanovich Mendeleev nasceu na Sibéria e era professor da Universidade de São Petersburgo quando descobriu a lei periódica. O elemento de número atômico 101 da tabela periódica tem o nome em homenagem a ele, o Mendelévio.
A tabela tem os elementos químicos dispostos em ordem crescente de número atômico e são divididos em grupos (ou famílias) devido a características que são comuns entre eles. Cada elemento químico é representado por um símbolo, por exemplo a prata é representada por Ag devido a seu nome no latim argentum. Cada elemento possui ao lado de seu símbolo o número atômico e o número de massa.
Classificação dos elementos
- Metais: São bons condutores de calor e eletricidade. São sólidos nas CNTP (com exceção do mercúrio), além de maleáveis e dúcteis.
- Não metais: São maus condutores de corrente elétrica e calor. Podem assumir qualquer estado físico na temperatura ambiente.
- Gases nobres: Apresentam baixa reatividade, sendo até pouco tempo considerados inertes.
Os elementos podem ser classificados em representativos ou de transição (interna e externa). Os representativos são aqueles cuja distribuição eletrônica termina em s ou p. Os elementos de transição externa são aqueles cuja distribuição acaba em d, e os de transição interna acabam em f. A localização de um elemento na tabela periódica pode ser indicada pelo seu grupo e seu período. Os elementos de transição interna são os que se encontram nas duas linhas bem embaixo na tabela e na verdade é como se estivessem localizados no no sexto e sétimo período do grupo três.
Cada linha no sentido horizontal da tabela periódica representa um período. Eles são em número de sete, e o período em que o elemento se encontra indica o número de níveis que possui. Por exemplo o sódio (Na) está no período três, o que significa que o seu átomo possui três camadas eletrônicas.
Já os grupos são as linhas verticais que apresentam elementos químicos que compartilham propriedades. Por exemplo o flúor (F) e o cloro (Cl) estão no grupo 17 (ou 7A) por possuírem alta tendência de receber elétrons, o que chamamos de eletronegatividade. Alguns grupos possuem nomes específicos como os listados abaixo e os demais recebem o nome do primeiro elemento de seu grupo.
Grupo 1: Metais alcalinos: esses elementos são muito reativos principalmente com a água. Esta reatividade aumenta conforme aumenta o número atômico e o raio do átomo. Todos os elementos desse grupo são eletropositivos, metais bons condutores de eletricidade, e formam bases fortes. São sólidos a temperatura ambiente, apresentam brilho metálico e quando expostos ao ar oxidam facilmente. São utilizados na iluminação no caso das lâmpadas de sódio, na purificação de metais e na fabricação de sabões sendo combinados com a gordura.
Grupo 2: Metais alcalino-terrosos: Possuem esse nome por serem geralmente encontrados na terra. São bastante reativos, porém menos que os metais do grupo 1. Também são eletropositivos e são mais duros e densos do que os metais alcalinos. São utilizados em ligas metálicas como é o caso por exemplo do Berílio (Be), na composição do gesso e do mármore sendo o caso do cálcio (Ca) e em fogos de artifício magnésio (Mg) e estrôncio (Sr).
Grupo 16 (ou 6A): Calcogênios: Os elementos desse grupo recebem esse nome derivado do grego que significa “formadores de cobre”. Neste grupo pode-se perceber facilmente analisando todos os elementos do grupo a presença de características metálicas e não metálicas. Os elementos mais importantes deste grupo são o oxigênio (O) e o enxofre (S) sendo o primeiro o gás utilizado inclusive em nossa respiração e o último é responsável inclusive pelo fenômeno da chuva ácida.
Grupo 17 (ou 7A): Halogênios: São os elementos mais eletronegativos da tabela periódica, ou seja, possuem a tendência de receber elétrons em uma ligação. Podem se combinar com quase todos os elementos da tabela periódica. O flúor por exemplo possui aplicação na higiene bucal.
Grupo 18 (ou 8A): Gases nobres: possuem essa intitulação devido a ser constatado antigamente que não possuíam tendência alguma a formarem ligações. Isto ocorre devido à estabilidade de seus orbitais da camada mais externa completamente preenchidos. Hoje alguns compostos conseguiram ser preparados com estes elementos e incluem geralmente o Xenônio (Xe) que possui a primeira energia de ionização muito próxima do oxigênio.

Comentários
Postar um comentário