Elemento químico (9º ano)
Elemento químico é o conjunto de átomos de mesmo número atômico. O número atômico é a quantidade de prótons que um átomo possui em seu núcleo. Desse modo, a menor parte ou partícula que conserva as propriedades de um elemento químico é um átomo só com aquele determinado número atômico.
Para entender como isso se dá, pense em uma gota do elemento químico mercúrio (Hg). Ela pode ser subdivida em outras gotas menores, que continuarão sendo mercúrio, pois conservam as mesmas propriedades. Do mesmo modo, o elemento químico é um conjunto de átomos com o mesmo número atômico, mas a menor parte é apenas um átomo.
Assim, na Tabela Periódica, apresentada em ordem crescente de número atômico, é exatamente esse número que identifica e diferencia os elementos químicos uns dos outros.

Fragmento da tabela periódica mostrando a ordem crescente de número atômico
Para identificar um elemento químico fora da Tabela Periódica, costuma-se colocar o símbolo do elemento no centro, número de massa (A) na parte superior e o número atômico (Z) na parte inferior. A figura abaixo mostra como isso pode ser feito para representar um elemento químico:
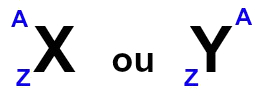
Representações gerais dos elementos químicos
Essa representação está de acordo com as normas da União da Química Pura e Aplicada (IUPAC). A seguir temos os elementos químicos sódio (Na) e cloro (Cl) sendo representados dessa forma:

Representação dos elementos sódio e cloro
Assim, o número atômico 11 identifica os átomos de sódio e o número atômico 17 identifica os átomos de cloro.
Por Jennifer Fogaça
Graduada em Química

AGORA É COM VC!!!!!!
No ano de 2032, comemoraremos a descoberta do nêutron, partícula localizada no interior do núcleo do átomo cuja principal função é estabilizá-lo por meio da diminuição da força de repulsão entre os elétrons. Entre os cientistas citados a seguir, qual deles foi o descobridor do nêutrons?
a) R. A. Millikan
b) E. Rutherford
c) J. Chadwick
d) J.J. Thomson
e) C. Goldstein
A figura abaixo apresenta um modelo atômico que contribuiu significativamente para o estabelecimento do conceito de átomo moderno, pois o cientista que o propôs defendia a divisibilidade do átomo em uma massa protônica positiva e em partículas negativas denominadas elétrons.
Sabendo que o modelo foi denominado pudim com passas, qual dos cientistas a seguir é o responsável por ele?
a) Dalton
b) Goldstein
c) Rutherford
d) Chadwick
e) Thomson
(ESPM-SP) O átomo de Rutherford (1911) foi comparado ao sistema planetário:
Núcleo............Sol
Eletrosfera.......Planeta
Eletrosfera é a região do átomo que:
a) contém as partículas de carga elétrica negativa.
b) contém as partículas de carga elétrica positiva.
c) contém nêutrons.
d) concentra praticamente toda a massa do átomo.
e) contém prótons e nêutrons.
(IME-RJ) Os trabalhos de Joseph John Thomson e Ernest Rutherford resultaram em importantes contribuições na história da evolução dos modelos atômicos e no estudo de fenômenos relacionados à matéria. Das alternativas abaixo, aquela que apresenta corretamente o autor e uma de suas contribuições é:
a) Thomson – Concluiu que o átomo e suas partículas formam um modelo semelhante ao sistema solar.
b) Thomson – Constatou a indivisibilidade do átomo.
c) Rutherford – Pela primeira vez, constatou a natureza elétrica da matéria.
d) Thomson – A partir de experimentos com raios catódicos, comprovou a existência de partículas subatômicas.
e) Rutherford – Reconheceu a existência das partículas nucleares sem carga elétrica, denominadas nêutrons.

Comentários
Postar um comentário